Retrovirusten replikaatio, esimerkkinä HIV
Elina Rintala. Mikro 400 –kurssi, kevät 2003.
Retrovirusten
replikaatio, esimerkkinä HIV 1
1. Johdanto 1
2. Retrovirukset 2
2.1. Rakenne 2
2.2. Käänteiskopioijaentsyymi 2
3. HI-virus 3
3.1. Rakenne 3
4. Replikaatio 4
4.1. Tunkeutuminen soluun 4
4.2. Uncoating- purkaminen 5
4.3. Replikaatio 6
4.4. Kokoaminen, kypsyminen ja vapautuminen 8
5. Johtopäätökset 9
6. Lähteet 9
Retrovirusten lisääntymistapa on muista viruksista poikkeava. Niiden replikaatio on monimutkainen ja kiinnostava; syynä lienee retrovirusten omalaatuinen rakenne. Tutkituin ja merkittävin retrovirus–suvun edustaja on HI-virus. Vuonna 2001 maailmassa arvioitiin olevan 40 000 000 AIDS/HIV –tartunnan saanutta, suurin osa näistä kolmannen maailman maissa (Tilastokeskus 2003).
1. Johdanto
Retrovirusten replikaatio
alkaa virionin hyökkäyksellä isäntäsolun pintaan. Virioni tunkeutuu soluun ja
purkaa perintöaineksensa solulimaan. Tämän jälkeen tapahtuu käänteinen
transkriptio ja DNA-kopion liittäminen isännän genomiin. DNA:sta valmistuu
transkription perusteella viruksen lähetti-RNA:ta ja RNA:ta uusia viruksia
varten. Tämä perintöaines pakkautuu ja kulkeutuu soluliman kautta ulos solusta.
HIV (human immunodeficiency virus) aiheuttaa immuunikatoa, AIDSia. Virus infektoi ja tuhoaa ihmisen puolustusjärjestelmälle välttämättömiä CD4+ T-auttajasoluja. T-soluja on kahta tyyppiä, TH1 –soluja, jotka liittyvät soluvälitteiseen vasteeseen, ja TH2 –soluja, jotka vastaavat humoraalisesta vasteesta. Keskimääräinen HIV-partikkeli / infektoitunut solu –puoliintumisaika in vivo –viljelyssä on 2.1 päivää. HIV partikkeleita valmistuu jopa 2*109 kappaletta vuorokaudessa. CD4 –soluja tuotetaan n. 2,6*109 kpl päivässä (Cann 1997).
2. Retrovirukset
2.1. Rakenne
Retrovirusten
virionit ovat halkaisijaltaan noin 80 100 nm. Niillä on kaikista muista
organismeista poikkeava kolminkertainen rakenne. Sisimpänä on
genomi-nukleoproteiinikompleksi. Tähän ovat kiinnittyneenä käänteiskopioija-,
integraasi- ja proteaasientsyymit. Kompleksi on kapsidin sisällä. Kapsidi on
kaikilla retroviruslajeilla samanlainen, sillä sitä ympäröivät
matriksiproteiinit. Niiden päällä on lipidivaippa, johon on kiinnittyneenä
glykoproteiineja (University of Turku 2003).
Retrovirusten
genomi koostuu kahdesta identtisestä RNA+-molekyylistä. Kumpikin
juosteista on kooltaan n. 8 - 10 kb (tuhatta emästä). Genomi on muihin
viruksiin verrattuna poikkeava. Se on ainoa diploidinen virusgenomi ja ainoa
viruksen RNA, jonka syntetisoi solun oma mRNA:ta tuottava koneisto.
Retroviruksen genomi on ainoa virusgenomi, joka käyttää erityistä tRNA:ta (=transfer-RNA=kuljettaja-RNA)
replikaation aloitukseen. Myöskin poikkeavaa on, että
sen 1-säikeinen polariteetiltaan positiivinen genomi ei toimi itse mRNA:na heti
infektion alussa kuten muilla viruksilla, joilla on vastaavanlainen
perimäaines. RNA:lla on 3'-päässä poly(A)-häntä ja 5'-päässä cap-rakenne.
Lähetti-RNA, joka toimii transkriptiossa alukkeena, on pariutuneena lähelle
RNA-genomin 5'-päätä. Retrovirusten geenien järjestys on aina seuraava:
5´-gag-pol-env-3´. (University of Leicster 2003)
2.2. Käänteiskopioijaentsyymi
Retrovirusten RNA on muodostunut siten, että sitä olisi mahdollista käyttää suoraan lähetti-RNA:na. Retroviruksilla on kuitenkin käänteiskopioijaentsyymi, joka kopioi viruksen positiivisen RNA:n DNA:ksi. Sana ”retro” merkitseekin tässä käänteistä. Syntetoitu DNA-molekyyli on kaksisäikeinen, ja se yhtyy isäntäsolun DNA:han, minkä jälkeen sen perusteella kopioidaan lähetti RNA syntyvän viruspartikkelin käyttöön (kuva 1).
Käänteiskopioijaentsyymi valmistaa DNA:ta RNA-templaatin mukaan. Tuloksena on siis DNA-RNA hybridi (yhdistelmä). Käyttämällä genomiin liittynyttä tRNA:ta alukkeena käänteiskopioijaentsyymi kopioi miinusnauhaisen cDNA:n. Samanaikaisesti samainen käänteiskopioijaentsyymi hajottaa templaattina olleen RNA:n. Kahden arvoiset kationit (Mg2+ ja Mn2+) ovat välttämättömiä entsyymin toiminalle, sillä ne vaikuttavat sekvenssispesifiseen sitoutumiseen (Esposito ja Graigie 1998). Entsyymi toimii myös RNAasina. Hajotetun RNA:n oligonukleotidit taas toimivat alukkeina tehtäessä plusnauhaista cDNA:ta miinusnauhaista cDNA:ta templaattina käyttäen.
Entsyymin
toimintaa säätelevien geenien toimintaa on tutkittu tietyissä myksobakteereissa
ja E. colissa. (Dimitrov, 1997). Retrovirusten
transkriptio on hyvin herkkä virheille -
käänteiskopioijaentsyymillä ei ole 3´® 5´ eksonukleaasiaktiivisuutta, ja näin
ollen se ei kykene tarkistusluentaan. Esimerkiksi fosfonoformaatti ja suramiini
inhiboivat käänteiskopiojaentsyymin toimintaa. Sen sijaan monet yleiset DNA- ja
RNA-inhibiittorit eivät siihen pure.
Replikaatio tapahtuu isäntäsolun tai viruksen omien
entsyymien avulla. Syntynyt virusgenomi pakataan viruksen omien lähettien
ohjaamien proteiinien avustuksella viruspatikkeleiksi (kuva 3). Tarkastellaan
replikaatiotapahtumaa lähemmin esimerkkinä HI-virus.
3. HI-virus
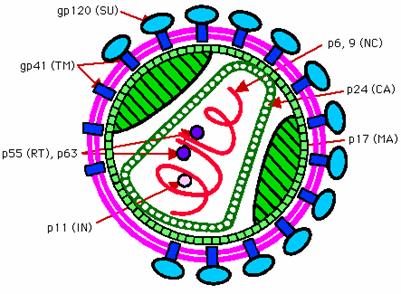
3.1. Rakenne

Kuva
1. HI-viruksen rakenne yksinkertaisena kaavakuvana (University of Leicster)
HI-virus kuuluu
retrovirusten heimoon (C-tyyppi), lentivirusten sukuun. Se on ikosahedraalinen,
vaipallinen ja melko monimutkainen RNA-virus. Virionin polymeraasi on
varaukseltaan positiivinen. Se on pituudeltaan n. 9 500 nukleotidiä ja siitä on
kaksi kopiota. Virioni on kooltaan (halkaisija) 60 – 70 nm, genomin koko on 12
kb ja se on polariteetiltaan positiivinen. Lentiviruksilla on noin 6 säätelevää
geeniä.
HI-virus
eroaa muista retroviruksista ulkonäöltään, sillä sen ydin on poikkeuksellisesti
kartion muotoinen. Virionin ikosahedraalinen kapsidi muodostuu proteiinista
p24. Lipidivaipan sisäpinnalle on kiinnittyneenä matriksiproteiini p17.
Proteiinit p17 ja p24 ovat gag-geenin
tuottamia. HIV:n jättiproteiini p120/41 kiinnittyy vaippaan. Se on vastuussa
viruksen hyökkäyksestä uuden isännän solukalvolle (kuva 3). Vaippaan on kiinnittynyt myös muita
HI-viruksen proteiineja, mm. antigeeneja.
Proteiinit
p9 ja p7 muodostavat ytimen yhdessä genomin kanssa. Myös kolme
viruksen entsyymiä ovat liittyneenä ytimeen:
käänteiskopioijaentsyymi (myös RNAasi H), integraasi (myös endonukleaasi) ja
proteaasi (kuva 1).
HI-viruksen RNA on diploidinen, eli se koostuu kahdesta yksittäisestä
1-säikeisestä positiivinauhaisesta RNA:sta (kooltaan siis 2 x 9,2 kiloemästä).
RNA:ssa ovat gag-, pol- ja env-geenit
ja 6 muuta geeniä. Nämä toimivat lisääntymisen säätelijöinä. Koska HI-viruksen
geenit tunnetaan, on niiden toiminnan perusteella voitu kehittää tilastollinen,
kodoneihin perustuva malli lentivirusten evoluutiosta
(Pedersen ym. 1998).
4. Repikaatio
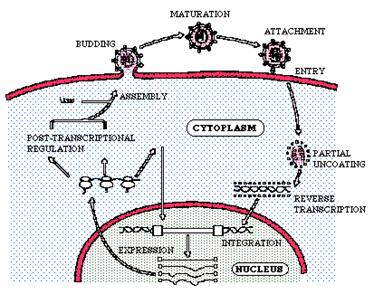
Kuva 2. Retroviruksen replikaation kaavio (University of Leicster 2003)
4.1. Tunkeutuminen soluun
Virusantireseptori sitoutuu isäntäsolun solukalvoreseptoriin. Reseptorit ovat suurimmaksi osaksi glykoproteiinia. Reseptorin ja antireseptorin vuorovaikutus vaatii ionien luomaa sähköstaattista jännitettä (poistovoimaa), mikä tekee reaktiosta ulkoisesta lämpötilasta ja energiasta riippumattoman.
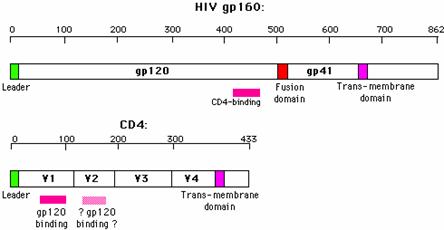
Kuva 3.
Proteaasit pilkkovat gp160 –proteiinin kahdeksi
alayksiköksi: gp120:ksi ja gp41:si. Gp 120 toimii HI-viruksen antireseptorina,
ja gp 41 liittää viruksen vaipan kohdesolun solukalvoon viruksen kiinnityttyä
solukalvoon (University of Leicster 2003)
HI-virus
tarttuu gp120-proteiinin välityksellä auttaja-T-solujen tai magrofagilinjan
solujen CD4-reseptoriin, sekä
CD4–reseptoriin liittyvään b-kemokiinireseptoriin (kuva 3). HI-viruksella on
mahdollisesti myös reseptori CD26, joka proteaasina katkaisee gp120-proteiinin
V3-kohdasta, jolloin gp41 voi liittää viruksen ja kohdesolun lipidivaipat
toisiinsa. V3-alue on myös viruksen tärkein antigeeninen kohta.
CD4-reseptorien osallisuus HI-viruksen soluun tunkeutumiseen on osoitettu vasta-aineiden ja proteiinien saostamiskokeilla. Jos ihmissolusta puuttuvat CD4-vasta-aineet, HIV ei voi niitä infektoida. Näin on havaittu olevan 10 %:lla valkoihoisista eurooppalaisista ja pienellä osalla muista ihmisroduista (Mikro 381-luennot 2003)
HIV:n
kiinnityttyä reseptoriin virus tunkeutuu hyvin nopeasti soluun. Tämä vaatii
energiaa. HI-viruksen kuorirakenne
sulautuu isäntäsolun solumembraaniin hydrofobisten aminohappojen avulla ja
kapsidi vapautuu suoraan solulimaan. Reaktio on toisin kuin useilla muilla
viruksilla riippumaton pH:sta, mutta jos olosuhteet eivät ole hydrofobisille
tekijöille suotuisat, reaktio häiriintyy (University of Leicster 2003)
4.2. Uncoating - purkaminen
Purkaminen
tarkoittaa vaihetta soluun tunkeutumisen jälkeen. Soluun tunkeutumisesta
eteenpäin ekspressioon johtavia tapahtumia ei retroviruksilta tunneta.
4.3. Replikaatio
4.3.1 Replikaatioprosessi (kuva 4)

Kuva
4. Kaavio replikaation etenemisestä
Retroviruksissa matriksiproteiini pysyy mahdollisesti kiinni solukalvossa virionin tunkeuduttua soluun. Käänteiskopioijaentsyymin toiminta, joka johtaa DNA:n synteesiin, tapahtuu tässä kapsidin jäänteessä solulimassa. Käänteiskopioijaentsyymi on sekä RNA:n että DNA:n ohjaama DNA-polymeraasi. Syntynyt kaksijuosteinen DNA on pidempi kuin virus-RNA (Madigan ym. 2000).
Tosiasiassa prosessi on kuitenkin monimutkaisempi, sillä retrovirusten RNA:ssa
on usein virheitä. Tällöin replikaatiokompleksin on vaihdettava toiseen
RNA-juosteeseen (juosteita on kaksi). Proviraalinen DNA kuljetetaan tumaan,
jossa se liitetään solun DNA:han viruksesta peräisin olevan
integraasi-entsyymin avulla (kuva 5).
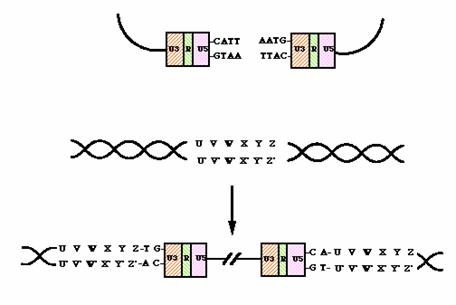
Kuva 5. 3´-päästä poistetaan 2 emästä. Isäntäsolun genomista poistetaan 6 nukleotidiä, jolloin sen 5´-pään fosfaatit kiinnittyvät virus-DNA:n 3´-päiden OH-ryhmiin. Väliin jäävä gappi korjataan. Reaktio vaatii ATP:n energiaa (University of Leicster, 2003).
Kaksijuosteisen
DNA:n (dsDNA) molemmissa päissä on LTR- (=long terminal repeat) -säätelyjakso,
joka koostuu alkuperäisen RNA:n 3'- ja 5'-päistä ja niiden väliin jäävästä
säätelysekvenssistä. Säätelyjaksossa on kiinnittymiskohdat erilaisille
promoottoreina toimiville viruksen ja solun proteiineille. dsDNA siirtyy
tumaan. Liittymiseen tarvitaan viruksen integraasientsyymiä, joka poistaa kaksi
nukleotidia provirus-DNA:n päistä ja vastaavasti pidentää hieman solun
katkaistun DNA:n päitä luomalla niihin lyhyen toistojakson. Vasta sitten
integroituminen onnistuu (Turun yliopisto 2003). Liittymisessä tarvitaan myös
magnesiumia (Esposito ja Craigie 1998). Replikaatio ei tapahdu, jos
integroituminen epäonnistuu.
HI-virus
kykenee replikoitumaan T-lymfosyyteissä kuitenkin vain silloin, kun ne
jakaantuvat. Näin ollen virus voi olla elimistössä pitkäänkin lepotilassa ja
myöhemmin aktivoitua solun aktivoituessa. Sekä solun että viruksen proteiinit
säätelevät HI-virusten replikaation kaikkia vaiheita tarkasti. Lentiviruksilla
on lisäksi täysin muista viruksista poikkeava transkription säätelykeinonsa.
Tietyt säätelyproteiinit (tat ja rev) eivät kiinnity pelkästään
DNA-provirukseen vaan myös RNA-transkriptiin. Vaikka HI-viruksen genomissa on
vain yhdeksän geeniä (kolme koodaa rakenneproteiineja ja kuusi sääteleviä
proteiineja), silmukoimiset mahdollistavat 30 erilaisen RNA:n muodostumisen.
Kaikkien näiden toiminta ei vielä ole selvillä. HI-virus leviää tehokkaimmin
suoraan solusta soluun fuusioitumisessa, mutta syytä tähän ei tiedetä.
HI-virukselle
syntyy kolmenlaisia mRNA-molekyylejä: täysimittainen (9,2 kiloemästä) mRNA
koodaa gag- ja pol-polyproteiineja, kerran silmukoitunut mRNA (4,5 kiloemästä)
env-, vif-, vpr- ja vpu-proteiineja ja useita silmukoitumisia läpikäynyt mRNA
(2 kiloemästä) tat-, rev- ja nef–proteiineja (Turun yliopisto 2003).
4.3.2. Syntyvät
säätelyproteiinit
Säätelyproteiinit
syntyvät alkuperäistä mRNA:ta eri tavoin silmukoimalla. Tat on voimakas
transaktivaattori, joka sitoutuu vastaavaan kohtaan proviruksen sekvenssissä.
Se kykenee kuitenkin sitoutumaan myös kaikkiin syntyviin viruksen RNA-
transkripteihin, koska niillä on samanlainen 5'-pää. Tat parantaa solun
RNA-polymeraasin tehokkuutta kyseisillä geenialueilla 1000-kertaiseksi
huolehtimalla, että lukemista jatketaan riittävän pitkään. Kaikkia viruksen
proteiineja luetaan, mutta tat-, rev- ja ne- proteiineja lukuunottamatta ne
kertyvät solun tumaan, kunnes rev-proteiinia on kertynyt riittävästi.
Rev-fosforiproteiini sitoutuu viruksen RNA:n RRE-kohtaan (=rev responsive
element). Kohta on env-geenin sisällä. Ilman rev-proteiinia mRNA:t eivät
silmukoidu ja jäävät tumaan.
Nef on soluliman proteiini, jota tarvitaan viruksen replikoitumiseen
makrofageissa. Sitä ei käytetä viruksen replikaatiossa T-soluissa. Se vähentää
kohdesolun CD4- ja IL-2-tuotantoa ja vaikuttaa mahdollisesti solun
aktivaatiotasoon.
4.3.3. Muut
proteiinit
Vif
-proteiini (= viral infectivity factor) tekee syntyvästä viruksesta mahdollisimman
infektiokykyisen. Vpu-fosfoproteiini edistää env-glykoproteiinin kypsymistä ja
viruksen vapautumista solukalvolta.
Gag-pol-transkripti transloidaan gag-polyproteiiniksi tai toisen ribosomin
lukukehyksen lukemana pol-proteiiniksi. Pol-proteiinit syntetisoivat
rakenneproteiineja, gag-proteiinit käänteiskopiojaentsyymiä ja RNAasi H:ta sekä
integraasia.
Replikaatiossa syntyvä RNA toimii mRNA:na gag-polyproteiinille, proteaasille ja pol-polyproteiinille.
4.4. Kokoaminen, kypsyminen ja vapautuminen
Virionin
kokoamismekanismia ei tunneta tarkasti. Kovalenttisesti sidotut RNA+:t
(2 kpl) kiinnittyvät ydinrakenteeseen. Nukleokapsidiproteiinin zinc-finger motif sitoo nukleotidejä.
Virusgenomin kokoaminen on järjestelmällistä työtä, ja symmetria takaa oikean
järjestyksen. Pakkaussignaalit ovat RNA:ssa. Kapsidit muodostetaan HIV:n
tapauksessa solukalvossa. Virionin vaipan proteiinit siirtyvät solun pinnalta
vaippaan eksosytoosissa. Gag-liittämisproteiini p55 sijaitsee solukalvon
lipidikerroksessa. Gag-proteiinikerros muodostuu proteiinien välisten vuorovaikutusten tai
viruksen RNA:n vaikutuksesta.
Muodostunut
virioni kuroutuu solukalvon läpi. 5 % gagproteiinista on muodossa, joka
sisältää käänteistä transkriptaasia, integraasia ja proteaasia. Tämä takaa,
että virionin infektiiviset osat ovat mukana maailmalle lähetettävässä
viruspartikkelissa.
5. Johtopäätökset
HI-viruksen replikaatio tunnetaan jo lähes täysin. Viruksen rakenteen ja toiminnan määrittämisestä on päästy kymmenien miljoonien HIV-tartunnan saaneiden ihmisten henkiä säästävän lääkkeen kehittelyvaiheeseen. Sekä viruksen rakenteen selvittämiseen että tämän tiedon hyödyntämiseen kuluu useita vuosia. Aiheesta kirjoitettujen artikkeleiden suuri määrä ja monipuolisuus osoittavat kuitenkin perustutkimuksen tarpeellisuuden. Hyvin tunnettua, vaikkakin omalaatuista HI-virusta voidaan myös käyttää mallintamaan muiden virusten toimintaa, ja sen sekvensseistä löytyy arvokasta vertailumateriaalia virusten fylogenian tutkimiseen.
6. Lähteet
Cann,
A.J., Principles of Molecular virology. 1997, Toinen painos. ACADEMIC
Dimiter
S. Dimitrov. 1997. How Do Viruses enter the
cells? The HIV Coreseptors Teach us a Lesson of
Complexity. Cell 91, 721-730.
Esposito,
D ja Craigie, R. 1998. Sequense specifity of viral end DNA binding by HIV-1 integrase
reveals critical regions for protein-DNA interaction. The EMBO
Journal 17, 5832-5843.
Kansanterveyslaitos.
Mannerheimintie 166, 00300 Helsinki. www.KTL.fi. Käyttöpäivä
20.3.2003. Päivitetty 19.3.2003, Webmaster
Madigan, M.T., Martinko, J.M ja Parker, J. 2000. Brock Biology of Microorganisms, 9.painos, Prentice Hall International,
Inc.,
Pedersen,
A-M.K., Wiuf, C. ja Christiansen B. 1998. A codon-based Model Designed to Describe
Lentiviral Evolution. Mol. Biol. Evol. 15, 1069-1081.
Salkinoja-Salonen, M., Sivonen K., ym. 2001.
Mikrobiologian perusteita, 1.painos. Gummerrus kirjapaino Oy, Jyväskylä
Tilastokeskus. Työpajakatu 13, Helsinki. www.tilastokeskus.fi. Käyttöpäivä 22.5.2003. Päivitetty 16.5.2003
Turun yliopisto, TURUN
YLIOPISTON VIRUSOPIN PERUSOPETUKSEN WWW-KOTISIVU
http://www.virology.utu.fi/tyvol/teaching/opetusmater/contents.html, Käyttöpäivä
29.4.2003
päivitetty
17.4.2003, PP
University of Leicester, UK, Course BS3035: Virology , http://www-micro.msb.le.ac.uk/3035/Retroviruses.html, Käyttöpäivä 20.3.2003, päivitetty 21.1.2003